Điện li là gì? Hiện tượng điện li có thể miêu tả như thế nào? Độ điện li được định nghĩa như thế nào? Làm thế nào để phân loại các chất điện li theo mức độ mạnh yếu? Các loại bài tập về chất điện li có thể được thực hiện như thế nào?
Khái niệm về điện li là gì? Độ dẫn điện của chất là gì? Các loại chất dẫn điện được phân loại như thế nào? Mời tác giả cùng khám phá những kiến thức thú vị trong bài viết này. Hiểu rõ về các chất dẫn điện sẽ giúp các học sinh dễ dàng giải quyết các bài tập và vấn đề liên quan đến dẫn điện.
1. Hiện tượng điện li:
Khi kết nối với cùng một nguồn điện, chỉ có bóng đèn trong cốc chứa dung dịch NaCl được bật sáng, trong khi dung dịch saccarozơ và nước cất không có khả năng dẫn điện.
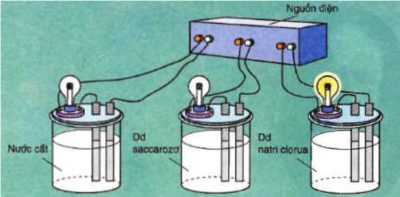
Nếu tiến hành các thử nghiệm tương đương, ta thấy các chất hóa học ancol etylic C2H5OH, glixerol C2H5(OH)3 không có tính dẫn điện. Natri Clorua và Natri Hydroxit đều là các chất rắn và khô.
Tuy nhiên, các chất lỏng như axit, bazơ và muối đều có khả năng dẫn điện.
Nguyên nhân:.
Từ năm 1887, A-rê-ni-ut (S.Arrhenius) đã đưa ra giả thuyết và sau đó đã được thực nghiệm và chứng minh rằng:
Bởi vì có chứa các ion có khả năng di chuyển tự do mang điện tích, điều này dẫn đến tính dẫn điện của các dung dịch axit, bazơ và muối được xác định.
Quá trình phân li các chất trong nước thành ion được gọi là sự điện li. Các chất tan trong nước phân li thành ion được xem là những chất có tính điện li.
Chất dẫn điện: là những chất khi hòa tan trong nước tạo thành dung dịch có khả năng dẫn điện.
Việc tách các chất trong nước thành ion được gọi là quá trình điện li. Những chất có khả năng điện li là những chất khi tan trong nước sẽ tách thành ion.
Các thành phần của chất điện li bao gồm axit, bazơ và muối.
Phương trình điện li được sử dụng để biểu diễn hiện tượng điện li. Ví dụ:.
Natri clorua được phân hủy thành ion natri và ion clo.
Axit nitric → ion hydro (H+) + ion nitrat (NO3-).
Natri hydroxit → Natri+ + Hydroxyl-.
3. Độ điện li là gì?
– Để biểu thị mức độ phân li ra ion của các chất điện li, ta dùng khái niệm độ điện li.
Độ điện li α (anpha) của một chất điện li là tỷ số giữa số phân tử phân li thành ion (n) và tổng số phân tử hòa tan (no) của chất đó.
Chúng ta có 0 ≤ α ≤ 1 hoặc 0% ≤ α ≤ 100%.
Chất không dẫn điện là chất không thể phân li: α = 0.
Khi dung dịch điện li có nồng độ cao, quá trình phân ly hoàn toàn xảy ra: α = 1 hoặc 100%.
Nếu nồng độ của dung dịch điện phân thấp hơn, quá trình phân hủy không diễn ra hoàn toàn với giá trị α nằm trong khoảng từ 0 đến 1.
Khi cường độ của chất điện li tăng thì độ dẫn điện của nó cũng tăng theo ở cùng một nhiệt độ và cùng nồng độ mol/lít. Điều này có thể được diễn đạt bằng cách khác.
Độ nồng độ mol của chất tan hòa tan thành Cp và tổng lượng mol của chất tan trong dung dịch Ct đạt giá trị α do sự cân bằng tỷ lệ giữa số phân tử và số mol.
Biểu thức:.
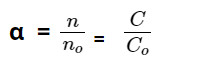
Khi n phân tử phân li thành ion, số phân tử hòa tan là no.
C được định nghĩa là nồng độ mol của chất tan thành ion, trong khi Co là nồng độ mol của chất được hòa tan.
Độ dẫn điện α phụ thuộc vào:
Tính chất của chất tan.
Tính chất cơ bản của chất hoà tan.
Nhiệt độ hiện tại.
Nồng độ ion.
4. Phân loại chất điện ly mạnh yếu:
4.1. Tính thuận nghịch của sự điện li:
Tính đối nghịch của hiện tượng dẫn điện và phương trình dẫn điện có thể là phương trình phản ứng đối nghịch do các ion dương và ion âm di chuyển không theo thứ tự và có thể va chạm vào nhau để hình thành phân tử mới.
4.2. Chất điện li mạnh- chất điện li yếu:
Chất điện giải mạnh: Khi tan trong nước, các phân tử được hòa tan thành ion.
Các chất axit mạnh như axit clohidric, axit nitric và axit sulfuric…
Các hợp chất mạnh như NaOH, KOH, Ba(OH)2, Ca(OH)2 ….
Các chất muối của axit mạnh và bazơ mạnh như Natri Clorua, Kali Nitrat, Kali Clorua, Kali Sunfat.
Khi ta thêm nước vào dung dịch điện li, độ mạnh của dung dịch sẽ giảm và không còn được gọi là dung dịch điện li mạnh nữa. Phương trình điện li của dung dịch cũng không còn đảo ngược như ban đầu. Na2SO4 → 2Na+ + SO42-.
Là chất dẫn điện yếu, một phần tử bị phân ly thành ion khi tan trong nước, nhưng phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ:.
Các acid nhẹ như acid hữu cơ, acid fluohydric, acid cyanhidric, ion NH4+….
Các chất bazơ như NH3, các hợp chất amin R-NH2 yếu.
Các phương trình điện hóa của chúng là những phương trình phản ứng đảo ngược và thuận.
Trạng thái cân bằng của điện tích.
Cân bằng điện li là một hệ thống cân bằng, và dĩ nhiên các phương trình phản ứng đảo ngược như đã nói là một thành phần của nó.
Le Chatelier đã cho biết rằng cân bằng điện li cũng được xếp vào loại cân bằng động, do đó cân bằng sẽ di chuyển theo hướng ngược lại với những nguyên nhân gây thay đổi cân bằng.
Khi di chuyển theo hướng thuận, sự phân tách trở nên hoàn toàn hơn và sự chuyển động cân bằng phụ thuộc vào nhiệt độ cũng như nồng độ mol/lít của dung dịch tan.
Chúng ta cần đánh giá sức mạnh của các chất điện li trong điều kiện nhiệt độ và nồng độ như nhau, bởi vì khi nhiệt độ tăng cao hoặc dung dịch trở nên loãng hơn, quá trình phân li sẽ diễn ra hoàn toàn hơn và cân bằng sẽ dịch chuyển theo hướng thuận lợi hơn.
Việc phân ly của chất điện giải hoàn toàn hay không phụ thuộc vào sức mạnh của nó, trong điều kiện cùng nhiệt độ và nồng độ mol/lít. Khi chất điện giải mạnh, sự cân bằng sẽ chuyển động theo hướng thuận, tuy nhiên khi chất điện giải yếu thì sự cân bằng sẽ dịch chuyển theo chiều ngược lại.
5. Các dạng bài tập về chất điện li:
Loại 1: Bài tập lý thuyết về điện tích, chất điện và viết phương trình điện.
Ví dụ:. Pha loãng dần dần một dung dịch axit sunfuric, người ta thấy độ dẫn điện của dung dịch lúc đầu tăng dần sau đó lại giảm dần. Hãy giải thích hiện tượng.
Hướng dẫn:.
Axit sulfuric phân hủy như sau:
H2SO4 chuyển thành ion H+ và HSO4- trong quá trình điện li hoàn toàn.
Ion HSO4- tương đương với ion H+ và ion SO42-, với giá trị hằng số cân bằng K bằng 10-2.
Khi pha mỏng hóa chất, độ dẫn điện sẽ tăng lên, gây ra sự tăng nồng độ ion. Do đó, độ dẫn điện cũng sẽ tăng cao hơn. Trong môi trường dung dịch rất mỏng, sự dẫn điện được coi như rất hoàn toàn. Khi đó, nếu tiếp tục pha mỏng, nồng độ ion sẽ giảm, dẫn đến sự giảm độ dẫn điện.
Cách bảo vệ lượng điện tích trong việc giải các bài tập về sự điện li.
Ví dụ:. Trong 2 lít dung dịch A chứa 0,2 mol Mg2+ ; x mol Fe3+ ; y mol Cl– và 0,45 mol SO42-. Cô cạn dung dịch X thu được 79 gam muối khan.
A/ Thực hiện tính toán giá trị của x và y trong phương trình sau đây: 2x + 3y = 7 b/ Hãy giải bài toán tìm nghiệm của phương trình 2x + 3y = 7.
Để tính được nồng độ mol/lít của mỗi muối trong A, người ta đã hòa tan 2 muối vào nước.
Hướng dẫn:.
A/ Áp dụng quy tắc bảo toàn điện tích, chúng ta có:
Với phương trình 2.0,2 + 3.X = 2.0,45 + y, ta có thể suy ra rằng 3x – y = 0,5 (1).
Cô có khả năng cạn khô được dung dịch chứa 79 gam muối khan.
0,2.24 plus 56 times x plus 35,5 times y plus 0,45.96 equals 79, therefore 56x plus 35,5y equals 31 (2).
Dựa trên (1) và (2), ta có giá trị của x là 0,3 và y là 0,4.
Dung dịch A gồm 2 chất muối, bao gồm Fe2(SO4)3 và MgCl2.
Nồng độ của CM(Fe2(SO4)3) là 0,15 M và CM(MgCl2) là 0,2 M.
Dạng 3: Cách tính độ acid kiềm (pH).
Ví dụ 1: Khi hòa tan 4,9 mg H2SO4 vào 1 lít nước, độ pH của dung dịch thu được là: .
Hướng dẫn:.
Với giá trị nH2SO4 là 4,9/98 = 0,05 mol, nồng độ của H2SO4 là 5.10-5 M.
Khi [H+] = 10-4 M, pH = -log(10-4) = 4.
Dung dịch A có giá trị pH là a. Khi cho dung dịch Ba(OH)2 vào, dung dịch A được trung hòa hoàn toàn và chúng ta lấy 10 ml dung dịch Ba(OH)2 để tính toán nồng độ [OH-] của nó. Từ đó, chúng ta có thể tính toán nồng độ [H+] của dung dịch A. Tiếp theo, dựa vào định luật bảo toàn điện tích, chúng ta tính được số mol HNO3 cần thiết để trung hòa dung dịch A. Cuối cùng, chúng ta tính toán được nồng độ mol/lit của dung dịch HNO3 và từ đó suy ra được giá trị pH của dung dịch HNO3.
Hướng dẫn:.
Với giá trị nHNO3 là 1,5.10-2.10-2 = 1,5.10-4, số mol nBa(OH)2 tương ứng là 7,5.10-5.
⇒ Giá trị của CM(OH-) là 1,5.10-4/10-2 = 1,5.10-2 ⇒ pOH bằng 1,8 ⇒ pH bằng 12,2.
Dạng 4: Các loại bài tập về hiện tượng điện li.
Trong dung dịch CH3COOH 0,1M đạt cân bằng với α là 1,32%, hãy tính nồng độ mol của các ion CH3COOH, CH3COO- và H+. Ví dụ 1.
Hướng dẫn:.
Axit axetic: H+ + ion axetat-.
Ban đầu C0 có tọa độ (0,0,0).
Tương ứng với C0, ta có phản ứng C0 . Α và C0 . Α . Α.
Thành phần C0 được cân bằng với tỉ lệ (1-α) C0 và α C0.
Vì vậy, [H+] và [CH3COO-] đều có giá trị bằng C0. Tham số α = 0,1 và giá trị là 1,32.10-2 M. Kết quả này cho thấy [CH3COOH] có giá trị là 1,32.10-3 M.
[CH3COOH] là 0,1M, và [CH3COO-] là 0,00132M, do đó [H+] là 0,09868M.
Ví dụ 2: Một hỗn hợp gồm các ion: Mg2+, Cl-, Br-.
Nếu phản ứng dd này với dd KOH không thừa thì sẽ tạo ra 11,6 gam kết tủa.
Cần chính xác 200 ml dung dịch AgNO3 2,5M để phản ứng với dung dịch này, kết quả thu được sau phản ứng là 85,1 g chất rắn kết tủa.
A. Xác định nồng độ ion trong dung dịch ban đầu khi thể tích là 2 lít.
B. Khi cô cạn dung dịch ban đầu, cô thu được bao nhiêu gam chất rắn?
Hướng dẫn:.
Công thức ion: Mg2+ + 2OH- → Mg(OH)2↓.
0,2 tương đương với 0,2 mol.
Ag+ kết hợp với Cl- tạo thành AgCl↓; Ag+ kết hợp với Br- tạo thành AgBr↓.
Đặt x, y tương ứng là số mol của ion Cl-, Br-.
Với giá trị của x và y là 0,2 và 0,3 tương ứng, ta có x + y = 0,5 (1) và 143,5x + 188y = 85,1 (2).
A. [Mg2+] and [Cl-] have the same concentration of 0.1 M, while [Br-] has a concentration of 0.15 M. B. Both [Mg2+] and [Cl-] have a concentration of 0.1 M, whereas [Br-] has a concentration of 0.15 M.
B. M = 35,9 gam được tính bằng công thức 0,2.24 + 0,2.35,5 + 0,3.80.
Loại 5: Loại bài tập về phản ứng trao đổi ion trong chất lỏng.
Ví dụ:. Dd X chứa các ion: Fe3+, SO42-, NH4+, Cl–. Chia dd X thành hai phần bằng nhau:
Phần 1: tác dụng với lượng dư dd NaOH, đun nóng thu được 0,672 lít khí (đktc) và 1,07 gam kết tủa.
Sau khi thu được kết tủa có khối lượng là 4,66 gam khi sử dụng BaCl2 dư, tổng khối lượng các muối không tan trong quá trình cô cạn dd X là (chỉ có nước bay hơi). Phần thứ hai của quá trình có tác dụng.
Hướng dẫn:.
Số mol của NH4+ và NH3 đều bằng 0,03 mol khi tính theo tỷ lệ 0,672/22,4.
Số mol nFe3+ là 0,01 và số mol nSO42- là 0,02 được tính bằng cách chia tỷ lệ khối lượng tương ứng.
Sử dụng định luật bảo toàn điện tích: 3.0,01 + 0,03 = 2.0,02 +x ⇒ giá trị của x là 0,02.
M = 0.0156 + 0.0318 + 0.0296 + 0.0235,5 = 3.73 gam.
Trọng lượng muối khô trong hỗn hợp X là 7,46 gam khi tính theo tỷ lệ 3,73.2.
Dạng số 6: Phản ứng phân hủy muối bằng nước.
Trình bày về môi trường của các dung dịch muối sau: Fe2(SO4)3; KHSO4; NaHCO3; K2S; Ba(NO3)2; CH3COOK.
Hướng dẫn:.
Phản ứng hóa học Fe2(SO4)3 tạo ra 2 ion Fe3+ và 3 ion SO42-.
Fe3+ + H2O ⇔ Fe(OH)2+ + H+.
Môi trường có tính axit.
KHSO4 → K+ + HSO4-.
Ion Hydrogen sulfate cộng với nước tạo thành ion sulfate và ion Hydroxonium.
Môi trường có tính axit.
Natri bicarbonat → Natri+ + Hydrocarbonat-.
HCO3- + Nước ⇔ CO32- + H3O+.
HCO3- + H2O có thể tạo thành H2CO3 và OH-.
⇒ Môi trường có độ pH trung bình.
K2S chuyển hóa thành 2K+ và S2-.
Ion sulfide âm + Nước ⇔ Ion hydro sulfide + Hydroxyl ion.
Môi trường kiềm.
Ba(NO3)2 → Ba2+ + 2NO3-.
⇒ Môi trường có độ pH trung bình.
CH3COOK → CH3COO- + K+.
Ion axetat + Nước ⇔ Axetic acid + Hydroxyl.
Môi trường kiềm..





