Như chúng ta đã biết, mọi vật thể trong tự nhiên cũng như trong nhân tạo đều được tạo thành bởi một chất này hay một chất khác. Vậy câu hỏi tiếp theo là chất này được tạo ra từ đâu? Đây là thắc mắc đã được đặt ra hàng nghìn năm trước và được các nhà khoa học giải đáp bằng khái niệm “nguyên tử”. Hãy cùng khám phá thêm chi tiết trong bài viết tổng hợp dưới đây của Monkey!
Lịch sử nghiên cứu về nguyên tử trong hóa học
Thực tế, khái niệm về nguyên tử đã được đề cập từ hàng nghìn năm trước. Lịch sử nghiên cứu về nguyên tử được chia thành nhiều giai đoạn, bao gồm thời cổ Hy Lạp, thế kỷ 18, lý thuyết nguyên tử trong thế kỷ 19 và thời kỳ của Giáo sư vật lý Henri Becquerel và vợ chồng Marie Curie.
Thuật ngữ “nguyên tử” xuất phát từ ngôn ngữ cổ Hy Lạp và có tên là “Atomos” (có nghĩa là không thể chia thành nhỏ hơn). Theo lý thuyết này, vật chất bao gồm các hạt riêng biệt. Lý thuyết nguyên tử là một trong nhiều cách để giải thích về vật chất và không gian dựa trên các dữ liệu thực nghiệm.
Có một số cột mốc quan trọng trong lý thuyết khoa học về nguyên tử:

John Dalton, sinh năm 1805, là một nhà hóa học, vật lý học và nhà khí tượng nổi tiếng người Anh. Ông đã đóng góp vào thuyết nguyên tử hiện đại và sử dụng khái niệm về nguyên tử để giải thích sự phản ứng tự nhiên và tính hòa tan trong nước của các nguyên tố. Ông đã chứng minh rằng các nguyên tố phản ứng theo tỷ lệ nhỏ và có những loại khí có khả năng hòa tan trong nước tốt hơn so với các loại khí khác.
Các nguyên tố hóa học chứa các nguyên tử cùng loại, duy nhất và kết hợp với nhau để tạo thành hợp chất hóa học.
Trong thuyết nguyên tử này, không có thông tin về kích thước cụ thể của nguyên tử mà chỉ có thể xác định qua quan sát là “rất nhỏ”.
Năm 1827, Robert Brown, một nhà thực vật học nổi tiếng người Scotland, đã sử dụng kính hiển để quan sát các hạt bụi trôi nổi trên mặt nước. Trong quá trình này, ông nhận ra rằng chúng di chuyển theo hình zic – zắc.
Năm 1865, Johann Josef Loschmidt, một nhà khoa học người Áo, đã có một khám phá đột phá khi nghiên cứu về nguyên tử. Ông đã thành công trong việc xác định kích thước của phân tử trong không khí.
Năm 1905, Albert Einstein, một nhà vật lý học vĩ đại người Đức, đã thành công trong việc phân tích khối lượng và kích thước của nguyên tử, cũng như xác nhận thuyết nguyên tử của John Dalton, một nhà hóa học và vật lý học.
Khái niệm Nguyên tử là gì?
Có hàng chục triệu chất khác nhau trong thực tế, nhưng chỉ có khoảng hơn 100 loại nguyên tử. Nguyên tử được mô tả như một quả cầu rất nhỏ, với đường kính khoảng 0.00000001 cm.
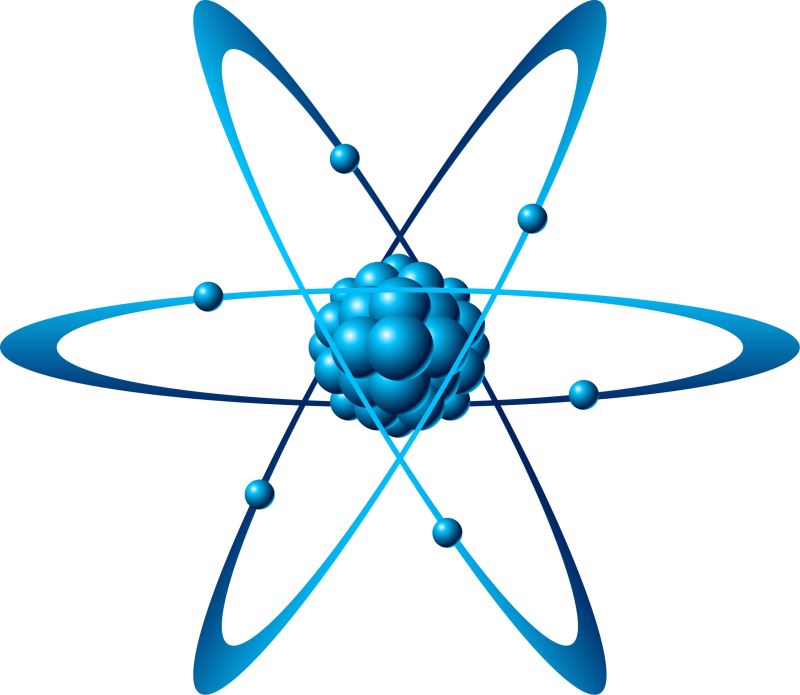
Sách giáo trình Hóa học 8 (NXB Giáo dục Việt Nam) đưa ra định nghĩa về nguyên tử như sau:
Nguyên tử là một hạt cực kỳ nhỏ và có trạng thái trung hòa về điện. Nguyên tử được cấu tạo từ một hạt nhân mang điện tích dương và một lớp vỏ bao phủ bởi một hoặc nhiều electron mang điện tích âm.
Electron được biểu diễn bằng ký hiệu e, có điện tích âm nhỏ nhất và được đánh dấu bằng dấu âm (-).
Nguyên tử được cấu tạo bởi các hạt nào?
Nguyên tử là một khối chất nhỏ nhất của một nguyên tố hóa học. Nó bao gồm hai phần chính: hạt nhân mang điện tích dương và vỏ chứa một hoặc nhiều electron mang điện tích âm.
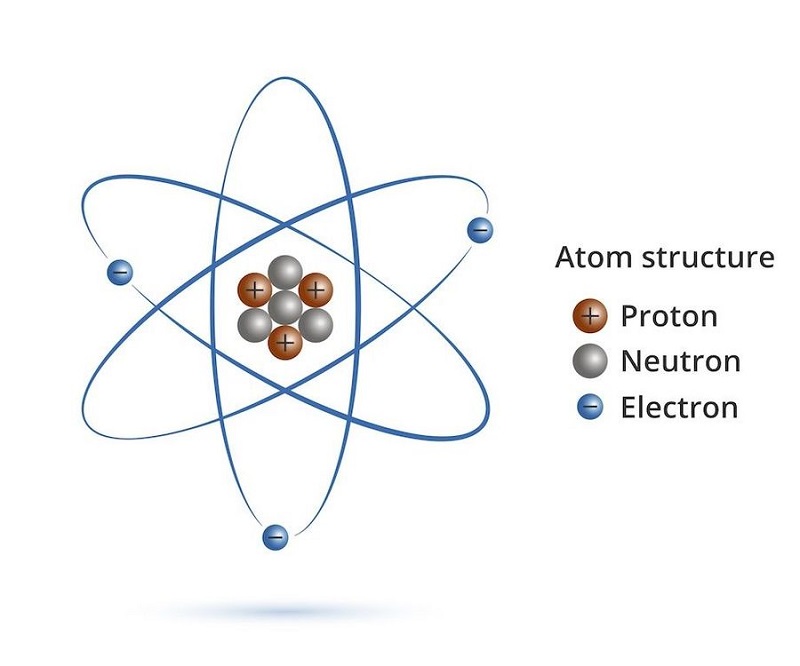
Một số khái niệm khác liên quan đến nguyên tử
Để có hiểu biết sâu hơn về bản chất của nguyên tử, chúng ta cần tìm hiểu một số khái niệm liên quan như hạt nhân nguyên tử, lớp electron trong nguyên tử và định nghĩa về nguyên tử khối.

Hạt nhân nguyên tử
Hạt nhân nguyên tử hình thành từ proton và nơtron, tọa lạc tại trung tâm của nguyên tử. Proton được ký hiệu là p và mang điện tích tương tự như electron nhưng có dấu trái dấu (+). Nơtron không mang điện và được ký hiệu là n. Các nguyên tử của cùng loại đều có số proton giống nhau trong hạt nhân.
Trong mỗi nguyên tử, số proton bằng số electron. Số p = số e. Trái ngược với điều này, proton và neutron có cùng khối lượng trong khi electron có khối lượng rất nhỏ, chỉ khoảng 0.0005 lần khối lượng proton. Do đó, các nhà khoa học xem khối lượng của hạt nhân là khối lượng của nguyên tử.
Lớp e trong nguyên tử
Electron trong nguyên tử chuyển động nhanh xung quanh hạt nhân và tổ chức thành các lớp với số lượng electron cố định. Electron là nguyên nhân khiến nguyên tử có khả năng tạo liên kết với nhau.
Số nguyên tử
Trên bảng tuần hoàn hóa học, mỗi phân tử đều có số nguyên tử riêng biệt. Dựa vào số nguyên tử, ta có thể phân biệt một phần tử này với các phần tử khác.
Số nguyên tử là gì? Số nguyên tử chính là số proton có trong hạt nhân nguyên tử của nguyên tố hóa học đó. Nếu nguyên tử không mang điện tích, thì số nguyên tử bằng số electron.
Nguyên tử khối
Khối lượng của một nguyên tử được tính bằng đơn vị cacbon được gọi là nguyên tử khối. Mỗi nguyên tố có nguyên tử khối riêng biệt.
Các nhà khoa học đã quy ước lấy 1/12 khối lượng của nguyên tử cacbon làm đơn vị khối lượng cho nguyên tử (viết tắt đvC) do nguyên tử có khối lượng rất nhỏ.
Phân biệt nguyên tử và phân tử
Cách phân biệt giữa nguyên tử và phân tử trong quá trình tìm hiểu về nguyên tử không phải là điều dễ dàng.
|
Đặc điểm so sánh |
Nguyên tử |
Phân tử |
|
Khái niệm |
Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm. |
Phân tử là hại đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất. |
|
Ví dụ |
Nguyên tử oxi, nguyên tử cacbon |
Oxy (O2), nước (H2O) |
|
Hình dạng |
Hình cầu |
Nhiều hình dáng |
|
Tính chất |
Không thể phân đôi nguyên tử |
Các nguyên tố trong phân tử có thể tách rời và kết hợp với nhau. |
|
Sự tồn tại |
Có thể tồn tại hoặc không tồn tại ở trạng thái tự do |
Tồn tại trong trạng thái tự do |
|
Tầm nhìn |
Không nhìn thấy bằng mắt thường |
Không thể nhìn thấy bằng mắt thường nhưng nếu có kính hiển vi vẫn có thể quan sát |
|
Khả năng phản ứng |
Phản ứng cao, có ngoại lệ nhất định |
Ít phản ứng |
|
Liên kết |
Liên kết hạt nhân |
Liên kết cộng hóa trị hoặc liên kết cộng ion |
Bài tập củng cố kiến thức bài học về nguyên tử
Sau khi đã hiểu rõ lý thuyết, hãy không quên thực hành bằng cách làm các bài tập trong sách giáo khoa, sách bài tập hoặc sách bổ trợ để ghi nhớ kiến thức tốt hơn. Dưới đây là một số bài tập tổng hợp từ sách giáo khoa Hóa học lớp 8 (NXB Giáo dục Việt Nam) kèm theo gợi ý đáp án để bạn tham khảo.

Bài 1: Ôn tập khái niệm nguyên tử
Hạt cực nhỏ, có tính điện trung hòa, tạo ra tất cả các chất. Nguyên tử có các phần tử mang điện tích dương và có vỏ được tạo thành từ đó.
Gợi ý về câu trả lời:
(1): Phân tử cơ bản của chất.
(2): nguyên tố.
Hạt nhân là một công cụ rewrite tiếng Việt, giúp viết lại đoạn văn để mang tính sáng tạo hơn.
(4) Một hoặc nhiều electron có điện tích âm.
Bài 2: Bài tập ôn tập SGK Hóa học 8 trang 25
Kim loại đồng và sắt được tạo nên từ nguyên tố nào? Hãy mô tả về cách sắp xếp các nguyên tử trong đơn chất kim loại.
Gợi ý về câu trả lời:
Đầu ra: Đồng là một loại kim loại được hình thành từ nguyên tố Cu, trong khi sắt là một kim loại được tạo thành từ nguyên tố Fe.
Cấu trúc nguyên tử trong đơn chất kim loại được tổ chức gọn gàng và tuân theo một trật tự cụ thể.
Bài học về nguyên tử là rất quan trọng trong chương trình Hóa học THCS. Vì vậy, hãy nhớ ôn tập kiến thức cẩn thận và hoàn thành bài tập đầy đủ để hiểu rõ về bài học này nhé. Monkey hy vọng các bạn sẽ học tốt!





