I. ĐỊNH NGHĨA VỀ KẾT NỐI HÓA HỌC.
1. Định nghĩa về sự kết nối.
Thông thường, đơn từng nguyên tử của các nguyên tố không tồn tại ở trạng thái tự do, thay vào đó chúng sẽ kết hợp với các nguyên tử khác để hình thành phân tử hoặc tinh thể, trừ khi đó là khí hiếm.
Việc liên kết giữa các nguyên tử để tạo thành phân tử hoặc tinh thể có độ bền cao hơn so với quá trình hóa học kết nối.
Quy tắc bát tử (8 điện tử).
Các hạt nhỏ của các chất đơn chất có xu hướng tạo liên kết với các hạt khác để đạt được cấu trúc ổn định giống như các khí hiếm có 8 electron (hoặc 2 electron với heli) ở vòng ngoài cùng, theo quy luật bát tử.
II. Quá trình hình thành các liên kết ion, anion và cation.
1. Phương thức tạo ra ion.2. Tính chất của ion.3. Phương pháp tạo ra ion và thuộc tính tương ứng.
Tạo ra các thành phần chứa điện được gọi là ion khi nguyên tử hoặc phân tử thêm hoặc mất electron trong quá trình phản ứng hóa học. Các hợp chất chứa liên kết ion được hình thành bởi sức hút tĩnh điện giữa các ion trái dấu hút nhau.
Các điều kiện dẫn đến việc hình thành liên kết ion:
Giữa các nguyên tố có tính chất khác nhau (kim loại điển hình và phi kim điển hình), hình thành liên kết.
Liên kết ion được xác định bởi sự chênh lệch hiệu độ âm điện giữa hai nguyên tử liên kết lớn hơn hoặc bằng 1,7, tuy nhiên có một số trường hợp ngoại lệ.
Dấu hiệu cho thấy phân tử có kết nối ion:
Phân tử hợp chất được hình thành từ các kim loại điển hình (kim loại thuộc nhóm IA, IIA) và phi kim điển hình (phi kim thuộc nhóm VIIA và Oxi).
Sự tạo thành liên kết ion xảy ra khi các ion kim loại và phi kim tạo thành các phân tử như NaCl, MgCl2, BaF2,…
Phân tử hợp chất muối bao gồm cation hoặc anion có nhiều nguyên tử.
Tất cả đều có liên kết ion, đó là liên kết được tạo thành giữa cation của kim loại hoặc amoni và anion của gốc axit, ví dụ như NH4Cl, MgSO4, AgNO3,…
Khi chuyển từ trạng thái rắn sang lỏng hoặc từ trạng thái lỏng sang khí, các hợp chất ion có nhiệt độ chuyển pha cao và đồng thời dẫn điện.
Ion được phân thành dương và âm ion.
Cation: Ion có điện tích dương.
Anion: Ion có điện tích âm.
2. Quá trình hình thành ion dương.
Ion có điện tích dương được gọi là ion dương hoặc cation.
Những hạt mang tính dương hay được biết đến với tên gọi cation sẽ được hình thành khi các hạt nguyên tử chuyển giao electron khi tham gia vào các phản ứng hóa học.
Chẳng hạn: Quá trình tạo ra Cation của nguyên tử Li(Z=3).
Thiết lập của e: 1s22s1.
Phản ứng hạt nhân 1s22s1 chuyển thành 1s2 và 1 electron.
(Li) (Li+).
Thường gọi là quá trình oxy hóa, Li trở thành Li+ và thêm một điện tử.
Cation liti được gọi là Li+.
Quá trình hình thành ion âm.
Ion có điện tích âm được gọi là ion âm hoặc anion.
Nếu các nguyên tử tham gia phản ứng hóa học nhận thêm electron, chúng sẽ trở thành các phần tử mang điện tích âm, còn được gọi là anion.
Ví dụ: Quá trình tạo ra anion của nguyên tử F(Z=9).
Bố trí e của nguyên tử là 1s22s22p5.
Phản ứng hóa học 1s22s22p5 + 1e sẽ tạo ra 1s22s22p6.
(F) (F-).
Thay đổi từ F + 1e thành F- được gọi là ”Hay”.
F được gọi là ion âm florua.
4. Ion đơn nguyên tử và ion âm đa nguyên tố.
Ion đơn nguyên tử là ion được hình thành từ một nguyên tử duy nhất.
Ví dụ: ion Li+, Na+, Mg2+ và ânion F-, Cl-…….
Ion đa nguyên tử là các nhóm nguyên tử mang điện tích dương hoặc âm.
Ví dụ: cation amoni NH4+, anion hidroxit OH-, anion sunfat SO42-, …….
III. Sự tạo thành liên kết ion
Sự kết hợp ion xảy ra do sức hút tĩnh điện giữa các ion có điện tích ngược nhau.
Ví dụ: Natri cộng với Clorua tạo thành muối Natri clorua.
Liên kết giữa ion Na+ và ion Cl- được gọi là liên kết ion.
Video giả lập – Kết nối ion.
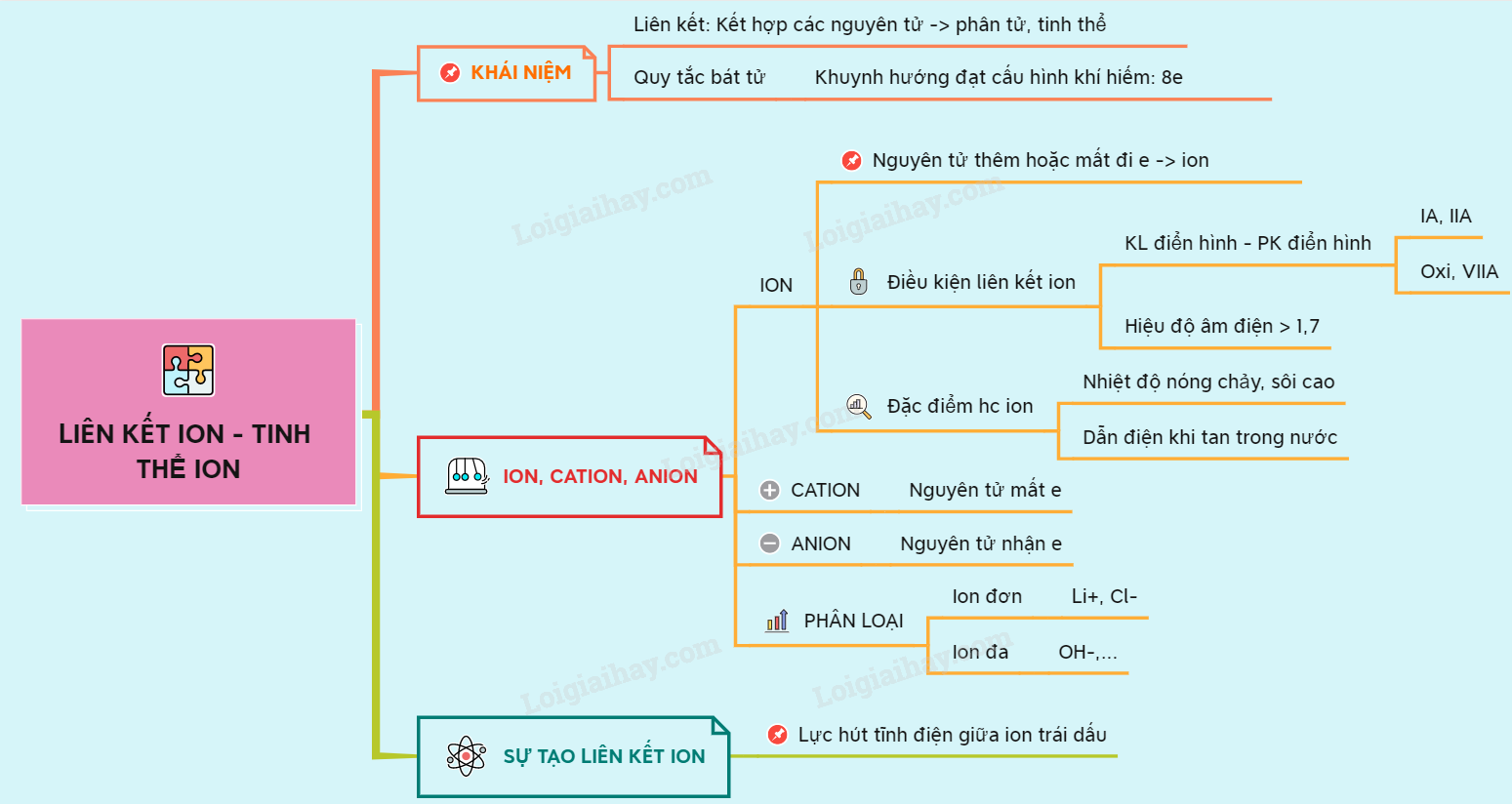
Bản đồ tư duy: Kết nối ion – tinh thể ion.
Loigiaihay.Com.

Tôi là Nguyễn Văn Sỹ có 15 năm kinh nghiệm trong lĩnh vực thiết kế, thi công đồ nội thất; với niềm đam mê và yêu nghề tôi đã tạo ra những thiết kếtuyệt vời trong phòng khách, phòng bếp, phòng ngủ, sân vườn… Ngoài ra với khả năng nghiên cứu, tìm tòi học hỏi các kiến thức đời sống xã hội và sự kiện, tôi đã đưa ra những kiến thức bổ ích tại website nhaxinhplaza.vn. Hy vọng những kiến thức mà tôi chia sẻ này sẽ giúp ích cho bạn!
