Halogen là một nhóm gồm các nguyên tử nào và chúng được xếp ở vị trí nào trên bảng tuần hoàn các nguyên tố hóa học? Các nguyên tử halogen có những tính chất hóa học nào? Hãy cùng Monkey khám phá thêm thông tin chi tiết trong bài viết dưới đây.
Nhóm halogen là gì? Vị trí của nhóm halogen trong bảng tuần hoàn
Nhóm halogen còn được biết đến là các nguyên tố halogen (trong tiếng Latin có nghĩa là tạo ra muối).
Nhóm halogen bao gồm nguyên tố flo (F), brom (Br), clo (Cl) và iot (I). Nguyên tố Atatin (At) không tồn tại trong tự nhiên và chỉ được tạo ra nhân tạo trong lò phản ứng hạt nhân, nên nó được xem xét chủ yếu trong các nhóm nguyên tố phóng xạ.
Halogen là một nhóm nguyên tố gồm các nguyên tố phi kim. Chúng có khả năng tạo thành các hợp chất có tính axit mạnh khi phản ứng với hiđro, từ đó tạo ra các muối đơn giản.
Các nguyên tố halogen nằm trong nhóm VIIA. Chúng đứng ở cuối của mỗi chu kỳ, ngay trước các nguyên tố hiếm.
Những phản ứng quan trọng minh họa tính chất của nhóm halogen
Chúng ta sẽ đi vào chi tiết từng phản ứng minh họa để giúp bạn đọc hiểu rõ hơn về các tính chất hóa học của nhóm halogen.
Tác dụng với kim loại
Các nguyên tố trong nhóm halogen phản ứng với hầu hết các kim loại, trừ Au và Pt, tạo ra muối halogenua và thường xảy ra ở nhiệt độ cao. Muối thu được thường có hóa trị cao nhất của kim loại. Một trường hợp đặc biệt là phản ứng giữa nguyên tố halogen I2 và sắt (Fe), tạo ra sản phẩm là FeI2 (Sắt có hóa trị II).
2M + nX2 → 2MXn
Tác dụng với nước
Flo có tác dụng mạnh với nước, brom và clo. Tuy nhiên, I ốt không phản ứng với nước. Dưới đây là các phương trình phản ứng tương ứng của chúng:
Tác dụng với dung dịch kiềm
Có một số nguyên tố halogen trong nhóm có khả năng tác dụng với dung dịch kiềm loãng và dung dịch kiềm đặc nóng. Dưới đây là một số phương trình phản ứng tiêu biểu:
Với dung dịch bazơ pha loãng lạnh:
Đặc biệt, flo có phản ứng như sau:
2F2 + 2NaOH → 2NaF + H2O + OF2.
Với dung dịch kiềm nồng đặc:
Tác dụng với muối halogenua
Các nguyên tố halogen (trừ flo – F2) có khả năng phản ứng với muối halogenua để tạo ra muối mới và halogen mới.
X2 + 2NaX’ → 2NaX + X’2.
(X’ là halogen có tính oxi hóa thấp hơn tính oxi hóa của halogen X).
Br2 + 2NaI → 2NaBr + I2.
Tác dụng với hidro
Halogen tác động với hidro để tạo thành hidro halogenua.
Ví dụ: Hydro + Xenon → 2 hydro xen.
Điều kiện xảy ra phản ứng với từng nguyên tố halogen như sau:.
Với flo (F2): Phản ứng có thể xảy ra ngay cả trong môi trường thiếu sáng.
Với iot (I2): Phản ứng có tính đối nghịch và cần được gia nhiệt.
Với brom (Br2): Phản ứng diễn ra trong điều kiện đun nóng ở nhiệt độ cao.
Với clo (Cl2): Phản ứng diễn ra khi được soi sáng.
Các phương trình điều chế một số nguyên tố trong nhóm halogen
Cách điều chế của mỗi nguyên tử trong nhóm nguyên tố halogen không giống nhau. Dưới đây là một số phương trình điều chế tiêu biểu cho từng nguyên tử trong nhóm này:
Điều chế Flo
Flo có thể được sản xuất trong công nghiệp thông qua phương pháp điện phân hỗn hợp KF và HF ở dạng lỏng. Trong quá trình này, cực dương được làm bằng graphit (than chì), còn cực âm được làm bằng thép đặc biệt hoặc đồng. Khi điện phân diễn ra, khí H2 được giải phóng ở cực âm, trong khi khí F2 được giải phóng ở cực dương.
2HF (phân hủy nhiệt+KF) → H2 + F2.
Điều chế Clo
Để sản xuất clo trong phòng thí nghiệm, axit clohidric đặc sẽ tác dụng với chất oxi hóa mạnh như MnO2 hoặc KMnO4. Đối với việc điều chế clo từ MnO2, cần sử dụng xúc tác nhiệt độ, trong khi đó, KMnO4 có thể được đun nóng hoặc không. Khí clo thu được dễ dàng hòa tan với khí hidro clorua và hơi nước. Vì vậy, để sản xuất khí clo tinh khiết, chúng ta sẽ tiếp tục dẫn khí qua bình rửa khí chứa dung dịch NaCl để giữ lại HCl và sử dụng axit sulfuric đặc để giữ lại hơi nước.
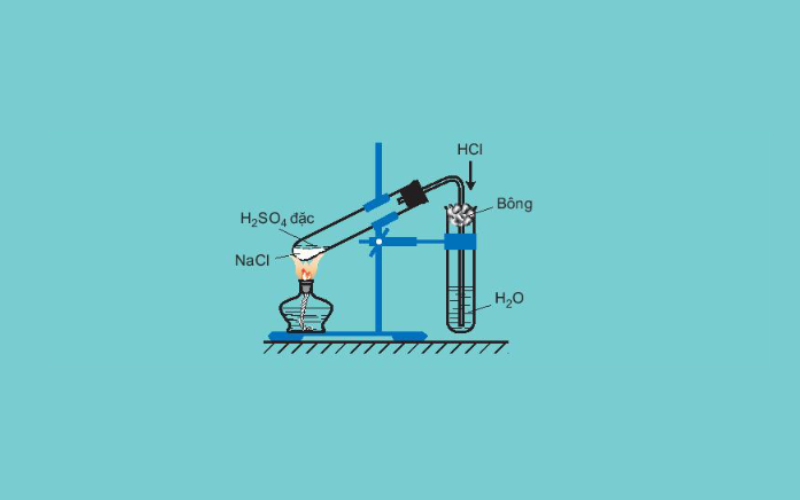
Trong lĩnh vực công nghiệp, người ta tạo ra khí clo bằng cách sử dụng phương pháp điện phân nóng chảy muối natri clorua hoặc điện phân dung dịch muối với màng ngăn.
Điều chế Brom
Brom trong công nghiệp được sản xuất từ nước biển bằng cách tách NaCl ra khỏi nước biển. Dung dịch sau khi tách NaCl có chứa NaBr. Sau đó, ta sử dụng khí clo oxi hóa NaBr để sản xuất Br2.
2NaBr + Cl2 → 2NaCl + Br2.
Điều chế iot
Iot trong công nghiệp có thể được tạo ra từ rong biển bằng cách sử dụng dung dịch chứa chất oxi hoá để oxi hoá I- thành I2.
2Natri iodua + Clo -> 2Natri clorua + Iot.
Monkey Math là một ứng dụng giúp con học toán và tiếng Anh một cách hiệu quả, tiết kiệm. Với nội dung dạy học đa phương pháp, ứng dụng này giúp bé phát triển tư duy não bộ và ngôn ngữ toàn diện với chi phí chỉ khoảng 2K/ngày.

Ứng dụng của nhóm halogen trong đời sống
Có nhiều nguyên tố khác nhau trong nhóm halogen và mỗi nguyên tố đều có ứng dụng đặc biệt trong cuộc sống. Dưới đây là một số ứng dụng của nhóm halogen mà Monkey tổng hợp để bạn tham khảo.

|
Nguyên tố |
Ứng dụng |
|
Clo |
|
|
Flo |
|
|
Brom |
|
|
Iot |
|
Tính chất vật lý của nhóm halogen
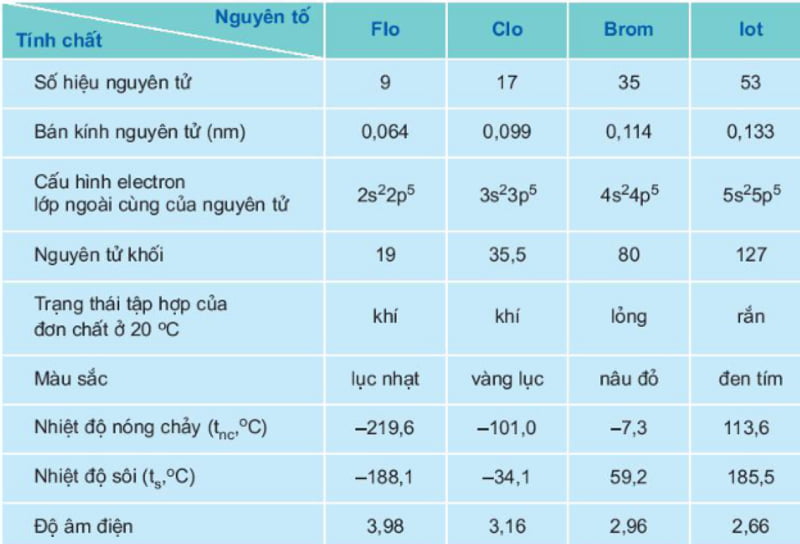
Để tìm hiểu về tính chất vật lý của halogen, chúng ta sẽ xem xét trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi và tính tan trong nước của chúng.

Đặc điểm chung của các nguyên tố nhóm halogen được tổng hợp trong bảng sau đây:.
Tính chất hóa học của nhóm halogen
Cấu trúc tương tự của lớp electron ngoài cùng là nguyên nhân khiến các đơn chất halogen có tính chất hóa học và thành phần tương đối giống nhau, cũng như tạo thành các hợp chất có tính chất tương tự nhau.
Tính chất halogen là những nguyên tố phi kim điển hình, từ flo đến iot, tính oxi hóa sẽ giảm dần.
Các chất halogen đơn chất có khả năng oxi hóa các kim loại và tạo thành muối halogenua. Khí hidro bị oxi hóa tạo ra các hợp chất khí không màu gọi là hidro halogenua. Những hợp chất khí này có thể hòa tan trong nước và tạo thành dung dịch axit halogenhidric.

Cấu tạo phân tử của nhóm halogen
Các nguyên tố halogen có lớp electron ngoài cùng đều chứa 7 electron. Lớp electron này được chia thành 2 phân lớp, gồm phân lớp s với 2 electron và phân lớp p với 5 electron.
Có 7 electron trong vòng ngoài cùng, chỉ cần thêm 1 electron để đạt được cấu hình của khí hiếm. Vì vậy, trong trạng thái tự do, hai nguyên tử halogen sẽ chia sẻ một cặp electron để tạo thành phân tử không cực (X – X hoặc X2, trong đó X đại diện cho các nguyên tố halogen).
Các phân tử X2 thường không bền và thường bị tách thành 2 nguyên tử X. Trong phản ứng hóa học, các nguyên tử này rất hoạt động vì chúng dễ nhận thêm 1 electron. Do đó, tính chất hóa học cơ bản của nhóm halogen là tính oxi hóa mạnh.
Bài tập về nhóm halogen SGK Hóa học 10 kèm lời giải
Bạn có thể tự tin làm các bài tập trong SGK để củng cố kiến thức về nhóm halogen dựa trên kiến thức lý thuyết đã được trình bày.

Bài tập 1 (SGK Hóa học 10, trang 96)
Có những loại kim loại nào tác dụng với dung dịch HCl loãng và khí Cl2 để tạo ra cùng một loại muối clorua kim loại?
A. Fe.
B. Zn.
C. Cu.
D. Ag.
Gợi ý giải pháp:
Zn + 2HCl → ZnCl2 + H2.
Khi Zn phản ứng với Cl2, ta thu được ZnCl2.
Sắt + 2 axit clohidric → Sắt clohidrat + Hiđro.
2Fe + 3Cl2 → 2FeCl3.
Bạc, Đồng không phản ứng với dung dịch axit clohidric.
Bài tập 2 (SGK Hóa học 10, trang 96)
Đặc tính nào sau đây không phải là đặc tính chung của các nguyên tố halogen (F, Cl, Br, I)?
Nguyên tử chỉ có khả năng hấp thụ thêm 1e.
Tạo thành bằng hidro hợp chất có liên kết hóa trị cộng có tính chất cực.
Có hiện tượng oxi hóa – 1 trong tất cả các hợp chất.
Lớp electron bên ngoài cùng của nguyên tử chứa 7 electron.
Gợi ý giải pháp:
Đáp án là C. F là nguyên tố có độ âm điện lớn nhất trong tất cả các hợp chất, nên chỉ có số oxi hóa -1. Các nguyên tố halogen khác, ngoài số oxi hóa -1, còn có thể có số oxi hóa +1, +3, +5 và +7.
Bài tập 3 (SGK Hóa học 10, trang 96)
Đặc điểm nào sau đây là đặc điểm chung của các chất halogen đơn chất (F2, Cl2, Br2, I2):.
Dưới điều kiện thông thường, chất khí là chất khí.
Có khả năng oxi hóa mạnh.
Vừa có tính oxy hóa, vừa có tính khuyễn.
Có tác dụng mạnh với nước.
Gợi ý giải pháp:
Đáp án chính xác là B. Nhóm halogen có tính oxy hóa mạnh.
Bài 4 (trang 96 SGK Hóa 10):
So sánh các nguyên tố halogen về các khía cạnh sau đây:
A) Cấu trúc nguyên tử và cấu trúc phân tử.
B) Đặc tính vật lý.
C) Tính chất hoá học.
Gợi ý giải pháp:
So sánh các nguyên tố halogen:
|
Đặc điểm so sánh |
Giống nhau |
Khác nhau |
|
Cấu tạo nguyên tử và cấu tạo phân tử |
Số lớp electron ngoài cùng có 7e. Ở trạng thái cơ bản, nguyên tử halogen đều có 1 electron độc thân. Phân tử 2 nguyên tử, liên kết cộng hóa trị không cực. Cấu hình electron lớp ngoài cùng ns2np5 |
Bán kính nguyên tử tăng dần từ flo đến iot. Lớp ngoài cùng của nguyên tố flo là lớp thứ 2 nên không có phân lớp d. Nguyên tử clo, brom và iot có phân lớp d còn trống. Ở trạng thái kích thích, nguyên tử clo, brom hoặc iot có thể có 3, 5 hoặc electron độc thân. Độ âm điện giảm dần từ flo đến iot |
|
Tính chất vật lý |
Trong nhóm halogen, tính chất vật lí biến đổi có quy luật: Trạng thái tập hợp, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi … |
Trạng thái và màu sắc: Đi từ flo đến iot, trạng thái tập hợp từ thể khí chuyển sang thể lỏng và thể rắn, có màu sắc đậm dần. Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần từ flo đến iot. Tính tan trong nước: Flo không tan trong nước. Các nguyên tố thuộc nhóm halogen còn lại tan rất ít trong nước, chủ yếu tan nhiều trong một số dung môi hữu cơ. |
|
Tính chất hóa học |
Giống nhau về tính chất hóa học của đơn chất cũng như về thành phần và tính chất của các hợp chất. Oxi hóa được hầu hết các kim loại tạo muối halogenua |
Khả năng oxi hóa của các halogen giảm dần từ flo đến iot. Phản ứng với kim loại, với hidro, với nước của các halogen cũng có khác nhau. |
Bài tập tính chất hoá học của halogen để học sinh tự luyện
Dưới đây là một số bài tập về nhóm halogen ngoài sách giáo khoa hóa học lớp 10 để các em áp dụng và tự luyện.
Câu 1. Axit có tính chất hóa học cơ bản gì?
A. Hiệu quả của kim loại.
Tác dụng của B với bazo.
Tác dụng với oxit kiềm.
Cả A, B, C đều chính xác.
Câu 2. Ứng dụng nào dưới đây không thuộc về axit clohidric?
A. Dùng để tạo ra các muối clorua.
B. Rửa sạch bề mặt kim loại trước khi hàn.
C. Được sử dụng trong công nghiệp chế biến thực phẩm và dược phẩm.
D. Sử dụng để làm chất tẩy rửa.
Câu 3. Dd HCl có thể tác dụng với các chất sau đây:.
A. Đồng, AgNO3. B. Nhôm, AgNO3.
C. Bạch kim, AgNO3. D. Nhôm, Ba(NO3)2.
Câu 4. Chỉ sử dụng quỳ tím có thể phân biệt được các chất hóa học sau: (trong dạng dung dịch).
A. Muối Natri clorua, Muối Barium clorua, axit clohydric. B. Bạch tạng nitrat, Natri hidroxit, Kali clorua.
C. Acid hydrochloric, potassium hydroxide, sodium chloride. D. Acid hydrochloric, sulfuric acid, sodium hydroxide.
Câu 5. Khối lượng dung dịch HCl 2M cần sử dụng để hòa tan 16g CuO là:.
A. 1.00ml B. 200ml C. 500ml D. 400ml.Output: A. 1.00ml B. 200ml C. 500ml D. 400ml.
Câu 6. Những chuỗi oxit nào dưới đây phản ứng được với dung dịch HCl.
A. CuO, ZnO, Na2O B. MgO, CO2, FeO.
C. NO, CaO, Al2O3 D. Fe2O3, CO, CO2.
Câu 7. Muối NaCl tồn tại chủ yếu dưới dạng gì?
A. Nước biển và natri clorua.
Trong cơ thể con người.
Trong lòng đất.
Có nhiều loại ở thực vật.
Câu 8. Tại sao không sử dụng clo làm chất khử qua nước?
A. Vì clo hòa tan trong nước.
B. Vì clo có trọng lượng cao hơn nước.
Vì clo độc nên.
D. Bởi vì clo có khối lượng lớn hơn không khí.
Câu 9. Tính chất vật lý của khí clo là gì?
A. Clo là một chất khí có màu vàng lục, mùi hắc và khá nặng, nó có khối lượng gấp 2,5 lần so với không khí. Ngoài ra, clo cũng có khả năng tan trong nước và được coi là một loại khí độc.
B. Chất khí có mùi hôi trứng.
C. Chất khí độc, khó tan trong nước.
D. Là một chất khí không màu, có khả năng hòa tan trong nước một cách rất nhiều.
Câu 10. Clo có đầy đủ các đặc tính của một chất không kim loại điển hình. Đúng hay sai?
Câu 11. Clo được sử dụng để thực hiện công việc gì?
A. Diệt khuẩn nước sử dụng.
B. Làm sáng vải sợi, bột giấy.
C. Tạo ra nước giaven, một hợp chất hữu cơ.
Cả A, B, C đều chính xác.
Câu 12. Liên kết hóa học không có cực phân?
A. Liên kết không vững.
B. Kết nối vững chắc.
C. Kết nối rất không ổn định.
D. Kết nối rất vững chắc.
Câu 13. Đại số nào sau đây không thay đổi theo chu kỳ và nhóm?
A. Độ điện âm.
B. Khối nguyên tử.
Năng lượng ion hóa.
Đường kính nguyên tử.
Câu 14. Các chất: H2SO4, HCl, O3, CO2. Có bao nhiêu chất mà cấu trúc có liên kết cho nhận?
A. 1.
B. 3.
C. 4.
D. 2.
Câu 15. Dãy bao gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s22s22p6 là:.
A. Lithium+, Fluoride-, Neon. C. Sodium+, Chloride-, Argon.
B. Natri, F-, Neon. D. Kali, Clorua, Argon.
Câu 16: Điện phân nung chảy một chất muối 11,7g halogenua NaX chúng ta thu được 2,24 lít khí (đktc).
A) Xác định yếu tố X ?
B) Tính thể tích khí HX thu được khi cho X tác dụng với 4,48 lít H2 ở điều kiện tiêu chuẩn?
C) Tính tỷ lệ phần trăm các khí sau khi phản ứng?
Nung 12,87 gam NaCl với H2SO4 đặc, dư, ta thu được bao nhiêu lít khí ở điều kiện tiêu chuẩn và bao nhiêu gam muối Na2SO4, biết hiệu suất của phản ứng là 90%.
Khi cho 31,6 g KMnO4 phản ứng với dung dịch HCl dư, sẽ thu được một số lượng Cl2 (ở đktc). Trong phản ứng này, hiệu suất của quá trình tạo ra Cl2 từ HCl là 75%. Hãy tính số lít Cl2 thu được.
Cho 0,896 lít Cl2 phản ứng với 200 ml dung dịch NaOH 1M ở điều kiện thường, ta thu được dung dịch X. Hãy tính nồng độ của các chất trong dung dịch X.
Câu 20: Trong phản ứng oxi hóa, MnO2 oxi hóa hidro clorua, tạo ra khí clo. Khí clo này có khả năng đẩy đi 12,7 gam iot từ dung dịch natri iotua. Tính khối lượng HCl là bao nhiêu?
Hy vọng rằng với những thông tin tổng hợp trên đây, bạn đã có cái nhìn rõ hơn về nhóm halogen cũng như các tính chất và ứng dụng điển hình của chúng. Hãy tiếp tục theo dõi chuyên mục Kiến thức cơ bản của Monkey để khám phá thêm nhiều thông tin thú vị hàng ngày. Nếu bạn thấy bài tổng hợp này của Monkey hữu ích, hãy chia sẻ nhé!





