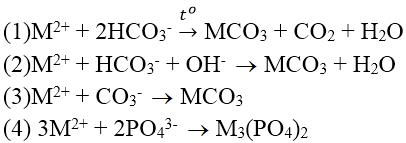Các Phương Pháp Làm Mềm Nước Cứng – Bài Tập Hóa Học Lớp 12
– Nước đi từ đầu nguồn đến nơi sử dụng sẽ hòa tan các nguyên tố vi lượng trong đó bao gồm cả Canxi và Magie, đặc biệt khi chảy qua các khu vực đá vôi, trầm tích hay các mỏ khoáng sản, một lượng lớn Canxi và Magie sẽ hòa tan vào trong nước gây ra hiện tượng nước cứng. Nước mưa, nước sông thường có độ cứng tương đối thấp, ngược lại nước ngầm có độ cứng khá cao.
1. Khái niệm
– Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+.
– Nước chứa ít hoặc không chứa các ion Mg2+ và Ca2+ được gọi là nước mềm.
2. Phân loại: có 3 loại
– Tính cứng tạm thời là tính cứng gây nên bởi các muối Ca(HCO3)2 và Mg(HCO3)2. Có thể tìm phương pháp xử lý bằng nhiều phương pháp đơn giản như nấu chín, lọc trao đổi ion,…
– Tính cứng vĩnh cửu là tính cứng gây nên bởi các Cl-, SO42- của Ca và Mg. Muối này bền nên xử lí phức bằng một số phương pháp tạp hơn.
– Tính cứng toàn phần gồm cả tính cứng tạm thời và tính cứng vĩnh cửu.
Biện pháp làm mềm nước cứng
1. Nguyên tắc
– Làm giảm nồng độ ion Ca2+ và Mg2+ trong nước cứng.
2. Phương pháp
a. Phương pháp xử lí bằng nhiệt: Xử lí được nước có tính cứng tạm thời.
Ca(HCO3)2 → CaCO3 ↓ + CO2 + H2O
Mg(HCO3)2 → MgCO3 ↓ + CO2 + H2O
b. Phương pháp xử lí bằng hóa chất
– Làm mềm nước cứng bằng vôi: Làm mềm được nước cứng tạm thời với nồng độ thích hợp
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
Ca(OH)2 + Mg(HCO3)2 → CaCO3 + MgCO3 + 2H2O
– Làm mềm nước cứng bằng Na2CO3 và Na3PO4
Ca2+ + CO32- → CaCO3
Mg2+ + CO32- → MgCO3
3Ca2+ + 2PO43- → Ca3(PO4)2
3Mg2+ + 2PO43- → Mg3(PO4)2
c. Phương pháp xử lí bằng trao đổi ion
– Cho nước cứng đi qua chất nhựa trao đổi ion (ionit), ở đây các ion Ca2+, Mg2+ bị hấp thụ và được trao đổi bởi các ion Na+ hay H+ của nhựa → nước mềm.

Bài tập về nước cứng tham khảo
Lý thuyết và Phương pháp giải
* Lưu ý:
– Nước có nhiều ion Ca2+, Mg2+ là nước cứng.
– Nước không chứa hoặc chứa ít các ion trên gọi là nước mềm.
+ Nước cứng tạm thời: chứa các ion: Ca2+, Mg2+, HCO-3.
+ Nước cứng tạm thời: chứa các ion: Ca2+, Mg2+, Cl- ,SO2-4.
Cách làm mềm nước:
Phương pháp hóa học:
Đối với nước cứng tạm thời, đun nóng hoặc dùng Ca(OH)2 rồi lọc kết tủa
Ca(HCO3)2 −tº→ CaCO3 + CO2↑ + H2O
Mg(HCO3)2 + Ca(OH)2 → Mg(OH)2↓ + 2CaCO3 + H2O
Cả 2 loại nước cứng đều có thể dùng dung dịch Na2CO3
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + 2NaHCO3
Ví dụ minh họa
Bài 1: Phát biểu nào sau đây là đúng?
A. Nước cứng là nước có chứa các muối CaCl2, MgCl2,…
B. Nước mềm là nước có chứa ít hoặc không chứa các ion Ca2+, Mg2+
C. Nước trong tự nhiên đều là nước cứng vì có chứa cation Ca2+, Mg2+.
D. Nước khoáng đều là nước cứng.
Hướng dẫn:
Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+.
Nếu nước có chứa Ca2+, Mg2+ nhưng dưới mức tới hạn thì không gọi là nước cứng.
Bài 2: Trong thể tích nước cứng có chứa 6.10-5 mol CaSO4 cần số gam Na2CO3 đủ làm mềm thể tích nước đó là:
A. 7,20 mg
B. 6,82 mg
C. 7,00 mg
D. 6,36 mg
Hướng dẫn:
Phản ứng: Na2CO3 + CaSO4 → CaCO3 + Na2SO4
Số mol Na2SO4 = số mol CaSO4 = 6.10-5 (mol)
Khối lượng Na2CO3 cần dùng là:
106 . 6.10-5 gam = 636.10-5 (gam) = 6,36 (mg)
Bài 3: Một cốc nước có chứa các ion: Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 mol), HCO3- (0,10 mol) và SO42- (0,01 mol). Đun sôi cốc nước trên cho đến khi phản ứng xảy ra hoàn toàn thì nước trong cốc:
A. có tính cứng toàn phần B. có tính cứng vĩnh cửu
C. là nước mềm D. có tính cứng tạm thời.
Hướng dẫn:
– Phản ứng khi đun sôi:
– Nhận xét: 2. nCa2+ + Mg2+ = 2.(0,02 + 0,04) = 0,12 > nHCO3-
Nên sau khi đun nóng HCO3- đã chuyển hết thành kết tủa và CO2. Trong dung dịch còn Cl-,SO42- (Mg2+, Ca2+) dư nên nước còn lại trong cốc có tính cứng vĩnh cửu.
Bài 4: Dung dịch A chứa các cation Mg2+, Ca2+, Ba2+ và 0,1 mol Cl-, 0,2 mol NO3-. Thêm V lít dung dịch K2CO3 1M vào dung dịch A để thu được lượng kết tủa lớn nhất. Giá trị của V là:
A. 150 ml
B. 300 ml
C. 200 ml
D. 250 ml
Hướng dẫn:
Các phương trình ion rút gọn:
Gọi x, y và z là số mol Mg2+, Ca2+ và Ba2+ trong dung dịch A. Dung dịch trung hòa điện nên: 2x + 2y + 2z = 0,1 + 0,2 = 0,3 → x + y + z = 0,15
Từ (1), (2) và (3) ⇒ nCO32- = x + y + z = 0,15 = nK2CO3
⇒ Vdd K2CO3 = 0,15/1 = 0,15 (lit)=150 (ml)
B. Bài tập trắc nghiệm
Bài 1: Chất nào sau đây được dùng để làm mềm nước cứng vĩnh cửu?
A. Na2CO3 và Na3PO4 B. Na2SO4 và Na3PO4.
C. HCl và Na2CO3. D. HCl và Ca(OH)2.
Bài 2: Một cốc nước có chứa các ion: Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl-(0,02 mol), HCO3- (0,10 mol) và SO42-(0,01 mol). Đun sối cốc nước trên cho đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc:cách tác hại của hoá gì
A. Có tính cứng hoàn toàn
B. Có tính cứng vĩnh cửu
C. Là nước mềm
D. Có tính cứng tạm thời
Bài 3: Trong một cốc nước có chứa 0,01 mol Na+; 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và 0,02 mol Cl-. Nước trong cốc là:
A. Nước mềm
B. Nước cứng tạm thời
C. Nước cứng vĩnh cửu
D. Nước cứng toàn phần
Bài 4: Cho các phản ứng mô tả các phương pháp khác nhau để làm mềm nước cứng (dùng M2+ thay cho Ca2+ và Mg2+) như sau:
Phương pháp nào có thể áp dụng với nước có tính cứng tạm thời?
A. (1)
B. (2)
C. (1) và (2)
D. (1), (2), (3) và (4)
Bài 5: Có các chất sau : NaCl, Ca(OH)2 ,Na2CO3, HCl . Cặp chất nào có thể làm mềm nước cứng tạm thời :
A. NaCl và Ca(OH)2
B. Ca(OH)2 và Na2CO3
C. Na2CO3 và HCl
D. NaCl và HCl
Bài 6: Có các chất sau:
(1) NaCl (2) Ca(OH)2 (3) Na2CO3
(4) HCl (5) K3PO4
Các chất có thể làm mềm nước cứng tạm thời là:
A. 1, 3, 5
B. 2, 3, 4
C. 2, 3, 5
D. 3, 4, 5