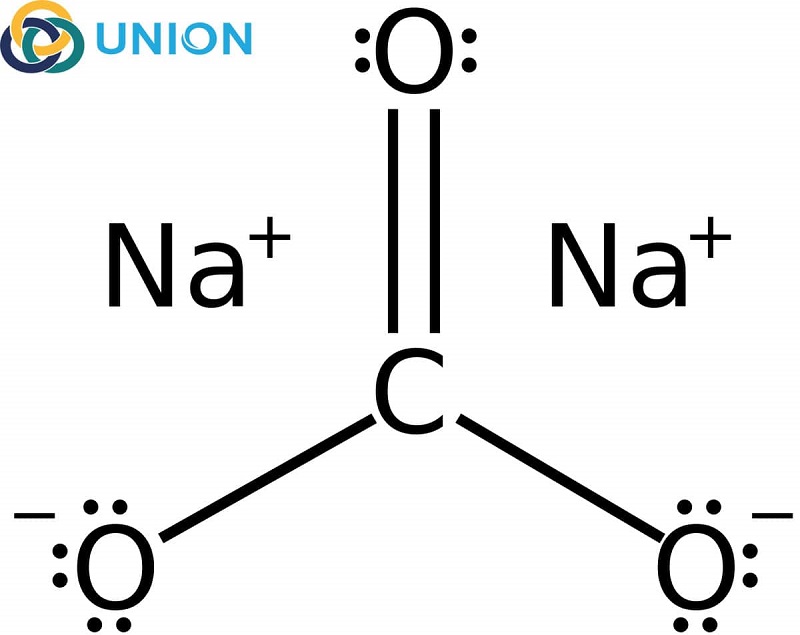
Na2CO3 là gì?
Natri Cacbonat còn gọi là Soda, là một loại muối cacbonat của natri có công thức hóa học là Na2CO3. Na2CO3 hay còn gọi là Soda Ash Light là muối natri không kết tủa, tất cả các muối của natri đều tan. Trong điều kiện thường, Na2CO3 khan là chất bột màu trắng, mùi nồng.
Natri carbonat là một muối bền trong tự nhiên, thường có trong nước khoáng, nước biển và muối mỏ trong lòng đất. Một số ít tồn tại ở dạng tinh thể có lẫn Canxi Cacbonat. Quá trình hình thành trong tự nhiên chủ yếu do sự thay đổi địa hình Trái Đất làm một số hồ gần biển hoặc vịnh bị khép kín, dần dần lượng muối tích tụ lại và bị chôn vùi vào lòng đất tạo thành mỏ muối. Lượng muối còn lại trong tự nhiên (nước biển) được hình thành do hòa tan khí CO2 trong không khí.
Theo các ghi chép lịch sử, từ 4.000 năm trước, người Ai Cập cổ đã biết khai thác và sử dụng Na2CO3 . Đến thế kỷ XV – XVI, tro rong biển đã được dùng để sản xuất xà phòng và thủy tinh.

Tính chất vật lý của Natri Cacbonat
Na2CO3 một chất dễ tan trong nước tạo thành hydrat. Với điều kiện khác nhau tạo thành hợp chất khác nhau:
- Dưới nhiệt độ 32,5ºC kết tinh thành Na2CO3.10H2
- Trong khoảng 32,5-37,5 ºC tạo thành chất Na2CO3.7H2O
- Trên 37,5 ºC thành Na2CO3.H2O
- Dến 107 ºC mất nước thành Na2CO3 khan.
Na2CO3 khan có dạng bột màu trắng, hút ẩm:
- Nhiệt độ nóng chảy 851 độ C,
- Nóng chảy không phân hủy tới 853 độ C, ngoài nhiệt độ này thì chất này nó sẽ phân hủy.
- Khối lượng riêng: 2,54 g/cm³, thể rắn
- Khối lượng mol: 105.9884 g/mol
- Điểm sôi: 1600 °C (2451 K)
- Độ hòa tan trong nước: 22 g/100 ml (20 °C)
Tính chất hóa học của Soda Ash Light
Na2CO3 là chất lưỡng tính tác dụng được cả axit và bazơ, Na2CO3 là muối trung hòa tạo môi trường trung tính nên nó có tác dụng đầy đủ tính chất hóa học như sau.
Tác dụng với axit mạnh tạo thành muối và nước giải phóng khí CO2:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
Tác dụng với bazơ tạo muối mới và bazo mới:
Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3↓
Tác dụng với muối tạo hai muối mới:
Na2CO3 + CaCl2 → 2NaCl + CaCO3
Chuyển đổi qua lại với natri bicacbonat theo phản ứng:
Na2CO3 + CO2 + H2O ⇌ 2NaHCO3
Khi tan trong nước, Na2CO3 bị thủy phân:
Na2CO3 → 2Na+ + CO32−
CO32− + H2O ⇌ HCO3− + OH− ⇒ Dung dịch Na2CO3 có tính base yếu.
Na2CO3 bị thủy phân mạnh tạo môi trường bazơ, làm đổi màu các chất chỉ thị:
- Chuyển dung dịch phenolphtalein không màu sang màu hồng.
- Na2CO3 làm quỳ tím chuyển sang màu xanh.
Ứng dụng của Natri Cacbonat (Na2CO3) trong xử lý nước bể bơi
Natri Cacbonat được biết đến là một hóa chất bể bơi mang lại hiệu quả vô cùng cao, dễ thực hiện mà khá an toàn. Chính vì vậy đây là phương pháp làm tăng độ pH cho bể bơi bằng Na2CO3 được rất nhiều người sử dụng.

1. Cơ chế làm cân bằng pH nước của Natri Cacbonat
Khi được châm vào bể, soda sẽ phân hủy mạnh tạo môi trường bazo do sinh ra ion OH-, phương trình phản ứng như sau:
Na2CO3 → 2Na+ + CO32−
CO32− + H2O → HCO3- + OH-
2. Cách sử dụng Na2CO3 làm sạch nước hồ bơi
Bước 1: Đo nồng độ pH trong nước bể bơi
- Tiến hành sử dụng bộ test thử nước bể bơi để đo bằng cách lấy mẫu nước ở độ sâu 0.5m để đảm bảo độ chính xác. Sau đó nhỏ 1 → 2 giọt Phenol vào ống thử rồi kiểm tra, đọc kết quả.


Tôi là Nguyễn Văn Sỹ có 15 năm kinh nghiệm trong lĩnh vực thiết kế, thi công đồ nội thất; với niềm đam mê và yêu nghề tôi đã tạo ra những thiết kếtuyệt vời trong phòng khách, phòng bếp, phòng ngủ, sân vườn… Ngoài ra với khả năng nghiên cứu, tìm tòi học hỏi các kiến thức đời sống xã hội và sự kiện, tôi đã đưa ra những kiến thức bổ ích tại website nhaxinhplaza.vn. Hy vọng những kiến thức mà tôi chia sẻ này sẽ giúp ích cho bạn!
