Tính nồng độ mol là dạng bài đơn giản nhất được coi như nền tảng để giải quyết các bài toán khó hơn. Vậy nồng độ mol là gì? Cách tính nồng độ mol của ion trong dung dịch như thế nào? Cùng theo dõi bài viết dưới đây để nắm chắc kiến thức về vấn đề này nhé!
Tính nồng độ mol của các ion trong dung dịch cần kiến thức gì?
Chất điện li mạnh là các chất khi hòa tan trong nước các phân tử đều phân li thành ion. quá trình phân li của chất điện li mạnh diễn ra một chiều nên khi tính toán nồng độ mol của ion trong dung dịch ta tính như phản ứng một chiều. Các chất điện li mạnh thường là những bazơ kiềm ( bazơ tan) NaOH,KOH,Sr(OH)2,… các axit mạnh như HNO3,H2SO4,HCl,…và các muối tan tốt như Na2CO3,KCl,KNO3,…

Chất điện li yếu là các chất khi hòa tan trong nước chỉ có một phần phân li thành ion phần còn lại vẫn tồn tại dưới dạng phân tử. Quá trình điện li của những chất này diễn ra theo chiều thuận nghịch nên khi tính toán nồng độ mol của ion tính toán như cân bằng hóa học. chất điện li yếu thường là những axit yếu như CH3COOH, H2CO3, HNO2,…bazơ yếu như Fe(OH)3,Fe(OH)2,… và các muối ít hòa tan như BaSO4,MgCO3,…
Viết phương trình điện li
Phương trình điện li của những chất liện li mạnh
- HCl → H+ + Cl-
- NaOH → Na+ + OH-
- H2SO4 →2H+ + SO42-
- CaCl2 →Ca2+ + 2Cl-
- Ca(OH)2→ Ca2+ + 2OH-
- NaCl →Na+ + Cl-
- Al2(SO4)3 → 2Al3+ + 3SO42-
Phương trình điện li của các chất liện li yếu
- CH3COOH ⇔H+ + CH3COO-
- H2S ⇔H+ + HS-
- HS⇔H+ + S2-
- H3PO4 ⇔H+ + H2PO4-
- H2PO4⇔H+ + HPO42-
- HPO22⇔H+ + PO43-
- Al(OH)3 ⇔Al3+ + 3OH-
- Zn(OH)2⇔Zn2+ + 2OH-
- Al(OH)3⇔H3O+ + AlO2sd-
- Zn(OH)2 ⇔2H++ ZnO2-
Các khái niệm, đại lượng và công thức tính toán nồng độ mol
Dung dịch được tạo nên từ chất tan và dung môi (dung môi thường dùng là H2O)
Khối lượng dung dịch
Khối lượng dung dịch được tính theo công thức: mdd = mct + mnước = Vdd.D
Trong đó:
- mdd: khối lượng dung dịch
- mct: khối lượng chất tan
- Vdd: thể tích dung dịch
- D: khối lượng riêng của dung dịch (gam/ml), với h20 có D =1.
Cách tính nồng độ mol
Nồng độ mol là gì?
Nồng độ mol là số mol chất tan trong 1 lít dung dịch.
Lưu ý: đơn vị lít(L) được sử dụng phổ biến hơn đơn vị ml
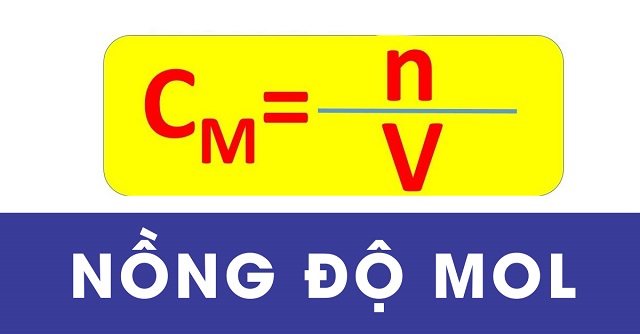
Công thức tính nồng độ mol
Nồng độ mol của một chất trong dung dịch được tính bằng số mol chất tan chia cho thể tích dung dịch. Công thức tính nồng độ mol như sau: Cm = n/Vdd
Trong đó:
- Cm: nồng độ Mol
- n: là số mol chất tan
- Vdd :là thể tích dung dịch lít
Từ công thức tính nồng độ mol trên ta có thể suy ra các công thức sau:
- Cách tính số mol chất tan trong: n = Cm x Vdd
- Cách tính thể tích dung dịch: Vdd = n/Cm
Ví dụ 1: Trong 500ml dung dịch có hòa tan 42 gam NaOH. Tính nồng độ mol NaOH của dung dịch?
Lời giải: 500ml=0,5l
nNaOH= 42/40= 1.05 mol
Áp dụng công thức tính nồng độ mol ta có:
Cm = n/Vdd = 1.05/0,5 = 21 ( M)
Ví dụ 2: Hòa tan hỗn hợp gồm NaOH a mol/lit và H2SO4 b mol/lit vào nước thì ta có dung dịch chứa các ion là:
NaOH → Na+ + OH-
mol/lit: a a a
H2SO4 → 2H+ + SO42-
mol/lit: b 2b b
Phương pháp tính nồng độ mol nhanh thường được dùng trong dung dịch – Phương pháp sử dụng sơ đồ đường chéo
Phương pháp được áp dụng vào giải các bài toán có trộn lẫn 2 dung dịch có cùng chất tan và bài toán pha loãng hoặc cô cạn dung dịch.
Dạng 1: Trộn lẫn hai dung dịch có cùng chất tan vào nhau
Dung dịch 1 có thể tích là V1, khối lượng là m1, nồng độ mol là C1, khối lượng riêng là d1. Dung dịch 2 có thể tích là V2, khối lượng là m2, nồng độ mol là C2 (C2 > C1), khối lượng riêng là d2.
Ta thu được dung dịch mới có khối lượng m = m1 + m2, thể tích V = V1 + V2, nồng độ mol C (C1 < C < C2) và khối lượng riêng d.
Sơ đồ đường chéo và công thức tương ứng với mỗi trường hợp là:
Đối với nồng độ mol/lít:
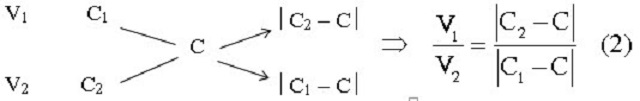
Trong đó: C1, C2, C quy ước là nồng độ mol/lít.
Lưu ý: khi sử dụng sơ đồ đường chéo:
- Chất rắn khan xem như dung dịch có C = 100%.
- Chất khí tan trong nước mà không phản ứng với nước (HCl, HBr, NH3…) xem như dung dịch có C = 100%.
- Dung môi xem như dung dịch có C = 0%.
- H2O có khối lượng riêng là d = 1 g/ml.
Dạng 2: Cô cạn, pha loãng dung dịch
Dung dịch 1 có thể tích là V1, khối lượng là m1, nồng độ mol là C1, khối lượng riêng là d1. Sau khi pha loãng hoặc cô cạn ta thu được dung dịch có m2 = m1 ; thể tích V2 = V1 nồng độ C (C1 > C2 hay C1 < C2).
Công thức tính nồng độ mol/lít:

Có thể thấy rằng để tính toán được các dạng bài toán phức tạp hơn bạn cần nắm rõ các công thức tính toán ở dạng cơ bản. Hi vọng với những thông tin trên sẽ giúp bạn biết cách tính nồng độ mol của các ion trong dung dịch một cách nhanh và chính xác nhất.

Tôi là Nguyễn Văn Sỹ có 15 năm kinh nghiệm trong lĩnh vực thiết kế, thi công đồ nội thất; với niềm đam mê và yêu nghề tôi đã tạo ra những thiết kếtuyệt vời trong phòng khách, phòng bếp, phòng ngủ, sân vườn… Ngoài ra với khả năng nghiên cứu, tìm tòi học hỏi các kiến thức đời sống xã hội và sự kiện, tôi đã đưa ra những kiến thức bổ ích tại website nhaxinhplaza.vn. Hy vọng những kiến thức mà tôi chia sẻ này sẽ giúp ích cho bạn!
